Specialty研究内容
研究内容の詳細
2.ネオアンチゲン
免疫チェックポイント阻害剤が奏功した患者に対する解析が進む中で、免疫チェックポイント阻害剤治療において活性化されたリンパ球が認識しているのはがん細胞の遺伝子変異産物であり、特にアミノ酸変異を含んだ変異タンパクが抗原として認識されていることが明らかになった。また、腫瘍における遺伝子変異が多いほど腫瘍内の免疫応答が活性化しており、免疫チェックポイント阻害剤の効果が期待できるのではないかと報告されている。このような遺伝子変異に基づく患者固有の腫瘍抗原はもともと体内に存在しないネオアンチゲンであり、腫瘍拒絶の標的分子として癌免疫の分野において最近特に注目されている。
がん細胞はそのがん化の過程で多くの体細胞遺伝子突然変異(somatic mutation)を蓄積していく。アミノ酸変異を伴う遺伝子変異産物のうち、一部のものは細胞内でプロテアソームによる分解を受けてペプチドに分解され、TAP(Transporter associated with antigen processing)により小胞体内へ輸送され、MHCクラスI分子への結合とアミノ酸のトリミングを受けたのち、細胞表面にMHCペプチド複合体として提示される。それがT細胞受容体によって認識される抗原となる。胸腺内に発現を認めないネオアンチゲンに対しては、免疫寛容が誘導されないため、高い免疫原性を有する可能性があることから、ネオアンチゲンを標的としたがん免疫治療の開発が期待されている。
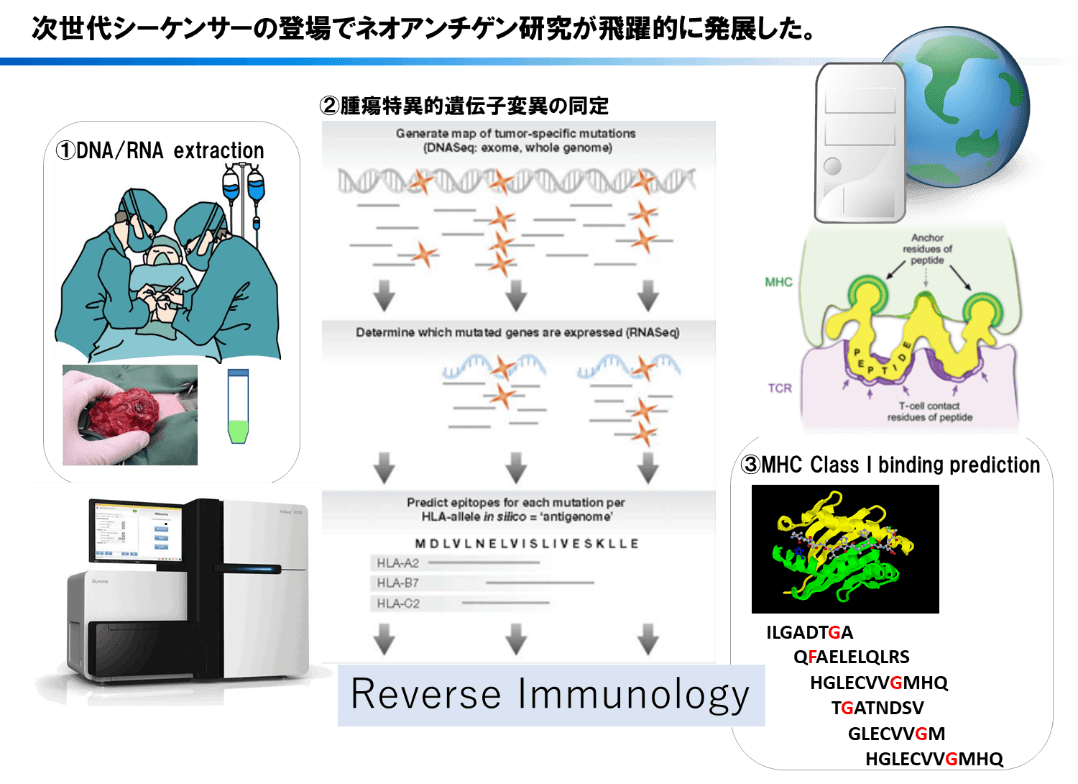
2.1ネオアンチゲン予測システムの構築
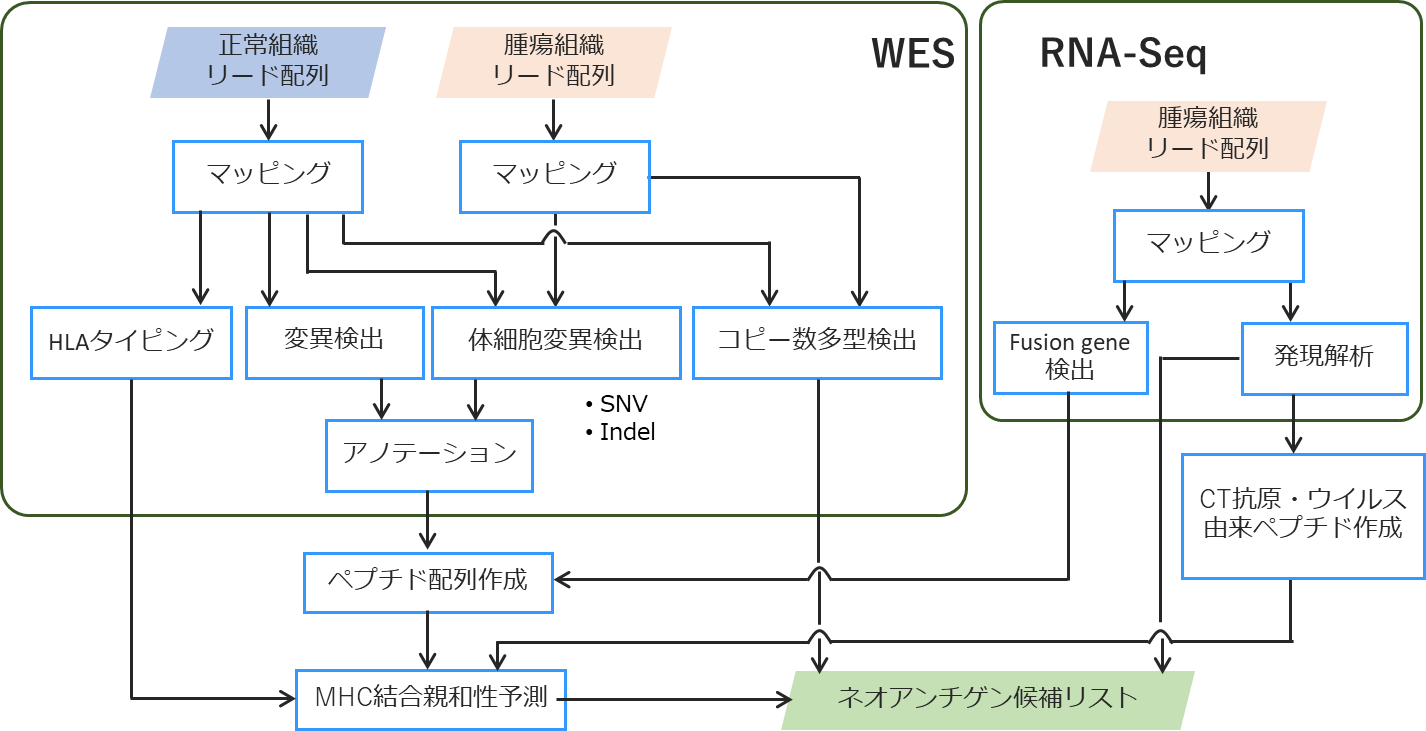
次世代シーケンサー(NGS)の登場によって、塩基配列決定技術が飛躍的に改善し、個人レベルでのゲノムが解読可能となった。タンパク質コーディング領域であるエクソンは全ゲノムの2%以下の領域にすぎない。ネオアンチゲンを予測する上では、コストや解析効率の面から全ゲノム解析(whole-genome sequencing)よりはイントロン領域や遺伝子間領域の情報を省いた全エクソン解析(whole-exome sequencing)が好まれている。また、個々の患者の腫瘍における特異的な遺伝子変異の同定のためには、個人の正常組織におけるゲノム情報と、腫瘍組織におけるゲノム情報の両方が必要である。腫瘍組織のゲノム情報のみでは、ヒトゲノムプロジェクトなどによって作成された参照配列との違いを知ることはできても、正常細胞も有している遺伝子多型なのか、腫瘍特異的な変異なのかを判別することはできないからである。同定された腫瘍特異的遺伝子変異から、患者のMHCと結合能の高いエピトープを予測することにより(MHC結合予測アルゴリズム)、患者固有の抗原を予測することが可能である。一方で、全エクソン解析のみでは変異遺伝子による転写産物が実際に発現しているのかどうかまでは判別できないため、トランスクリプトーム解析(RNA-seq)のデータを用いた発現解析を行い、発現している変異遺伝子に絞り込むことも重要である。このような、次世代シーケンサーによる遺伝子解析とMHC結合予測アルゴリズムを組み合わせてneoantigen候補を予測するアルゴリズムが、現在世界中で使用されている。
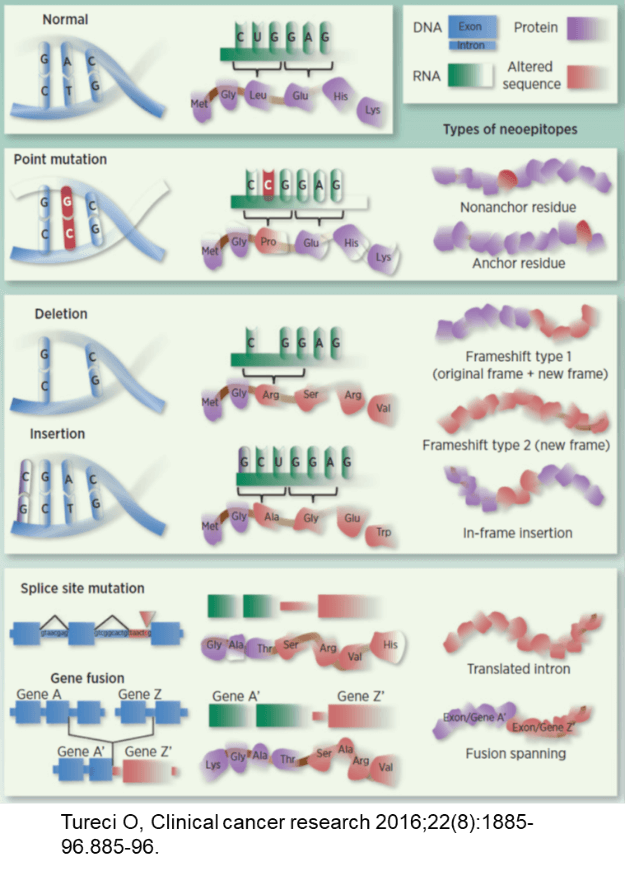
ネオアンチゲンには、1bpの塩基置換である「一塩基多型(SNV)」による1アミノ酸置換だけでなく、フレームシフトによって発生するアミノ酸配列が重要である。また、融合遺伝子によってできた新しタンパクの結合部分がネオアンチゲンとしてT細胞に認識される。がん細胞に生じた遺伝子変異から、ネオアンチゲンになる可能性が高いペプチドを予測するために、これまでの遺伝子解析技術やがんワクチン開発で蓄積されたエピトープ予測技術(MHC分子への結合予測)を統合し、ネオアンチゲン同定パイプラインを構築しました。
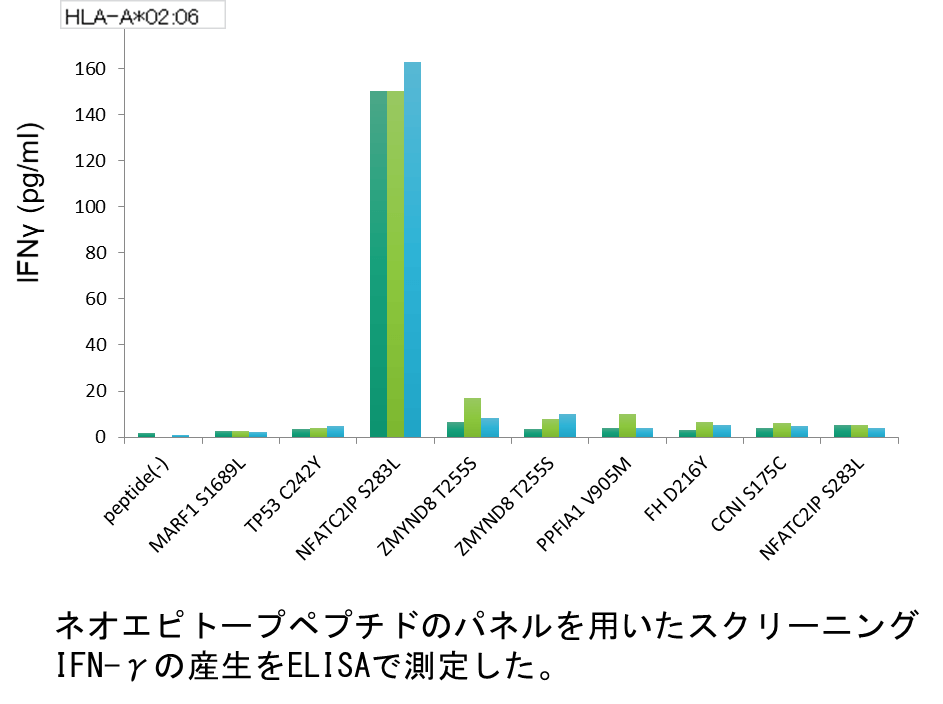
どの方法で絞り込まれたネオアンチゲン候補も、真に抗原性を有するか(本当にがん細胞を認識するT細胞が誘導されるか?)どうか検証するまでは「真のネオアンチゲン」とは言えない。ネオアンチゲン候補に対してCTLが反応するかどうか、実際に免疫学的に検証する必要がある。そのために、我々の研究室では、同一患者から採取したリンパ球やHLA導入トランスジェニックマウスを利用し、古典的な細胞生物学的手法を用いた免疫アッセイ法によるT細胞の反応の確認に力を入れています。
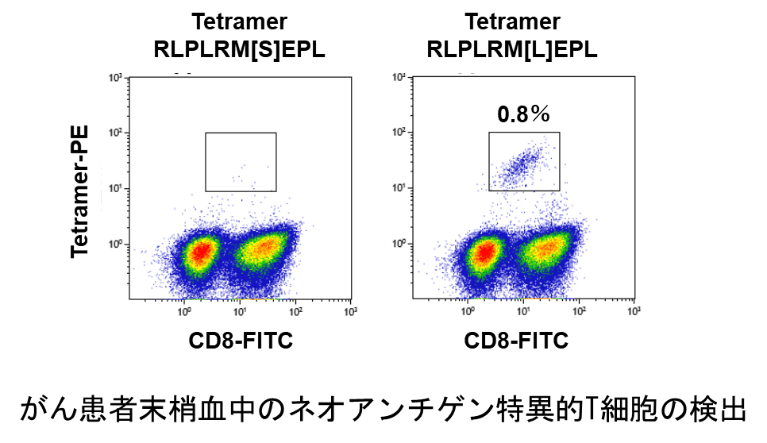
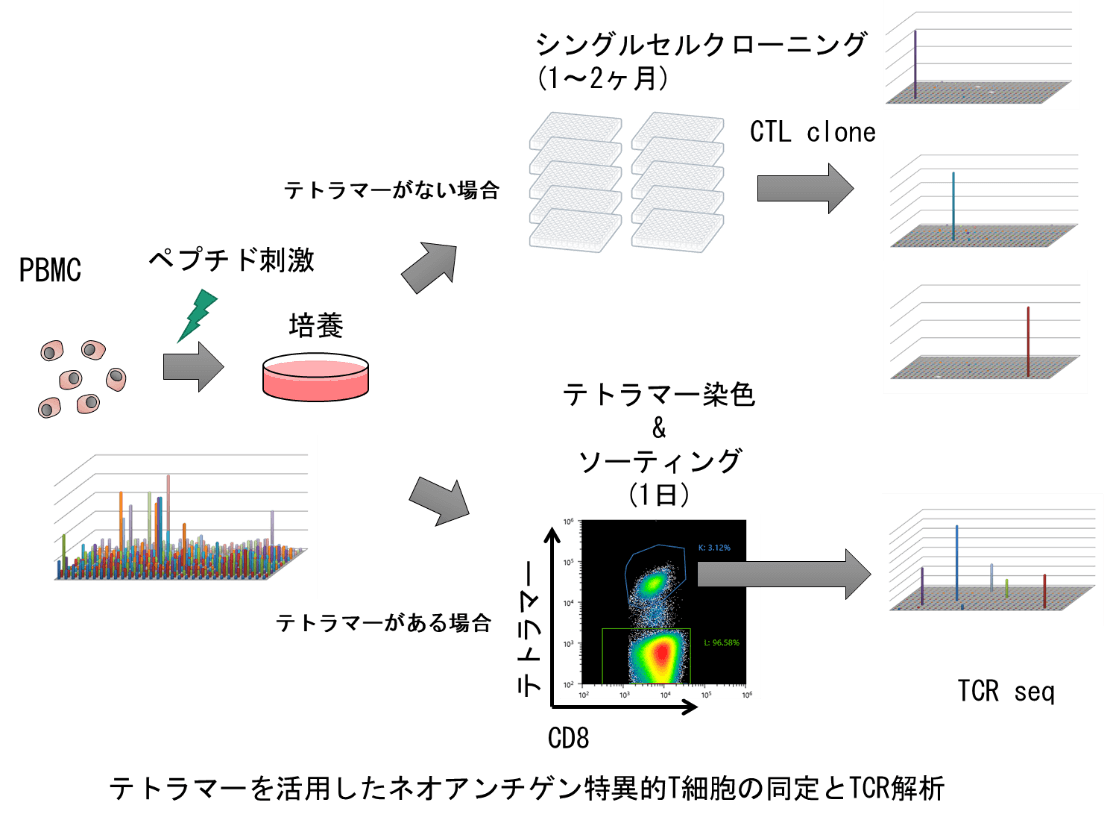
2.2ネオアンチゲン特異的TCR遺伝子のクローニングと遺伝子導入T細胞治療の開発
抗腫瘍免疫応答解析技術、ネオアンチゲン同定技術と、TCR遺伝子解析技術を融合して、ネオアンチゲンを標的としたがん免疫細胞治療法の開発に取り組んでいます。ネオアンチゲン特異的T細胞からそのTCR遺伝子をクローニングして、新しいリンパ球に遺伝子導入することで、腫瘍特異的T細胞を作製し、強力ながん治療に活用することが可能になると期待されます。
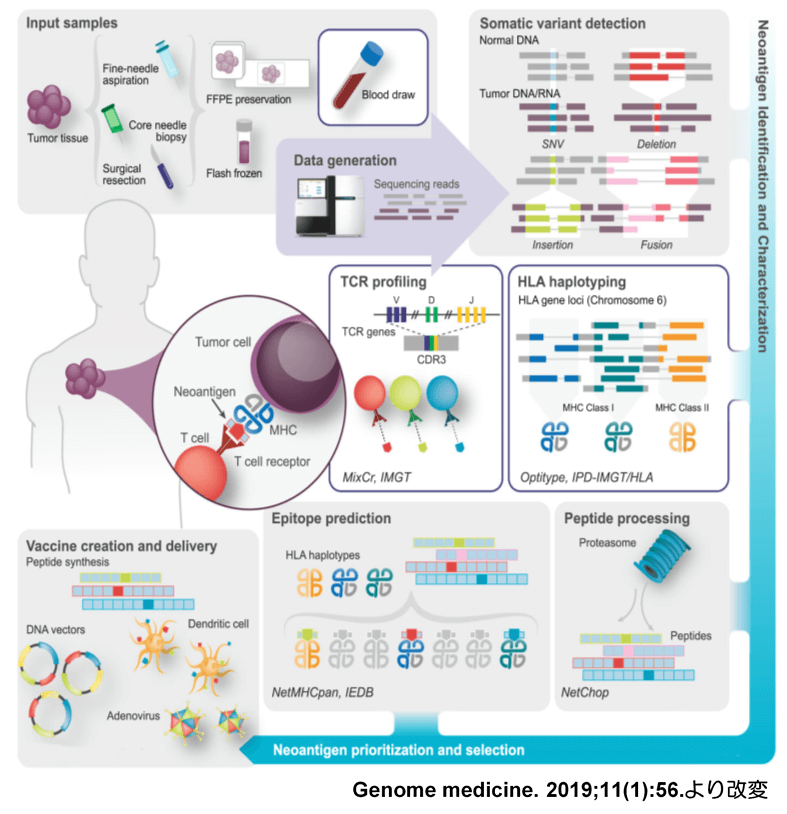
手術検体からTILを単離して、scRNA-Seqにより、シングルセルレベルでTILの発現しているTCR遺伝子情報とトランスクリプトーム情報を解析し、ネオアンチゲン特異的T細胞を同定する手法の確立を目指しています。

- 発表論文
-
- Matsushita H, Sato Y, Karasaki T, Nakagawa T, Kume H, Ogawa S, Homma Y, Kakimi K. Neoantigen Load, Antigen Presentation Machinery, and Immune Signatures Determine Prognosis in Clear Cell Renal Cell Carcinoma. Cancer Immunol Res. 2016 May;4(5):463-71.
- Karasaki T, Nagayama K, Kuwano H, Nitadori JI, Sato M, Anraku M, Hosoi A, Matsushita H, Takazawa M, Ohara O, Nakajima J, Kakimi K. Prediction and prioritization of neoantigens: integration of RNA sequencing data with whole-exome sequencing. Cancer Sci. 2017 Feb;108(2):170-177.
- Matsushita H, Hasegawa K, Oda K, Yamamoto S, Nishijima A, Imai Y, Asada K, Ikeda Y, Karasaki T, Fujiwara K, Aburatani H, Kakimi K. The frequency of neoantigens per somatic mutation rather than overall mutational load or number of predicted neoantigens per se is a prognostic factor in ovarian clear cell carcinoma. Oncoimmunology. 2017 Jun 16;6(8):e1338996.
- Nejo T, Matsushita H, Karasaki T, Nomura M, Saito K, Tanaka S, Takayanagi S, Hana T, Takahashi S, Kitagawa Y, Koike T, Kobayashi Y, Nagae G, Yamamoto S, Ueda H, Tatsuno K, Narita Y, Nagane M, Ueki K, Nishikawa R, Aburatani H, Mukasa A, Saito N, Kakimi K. Reduced Neoantigen Expression Revealed by Longitudinal Multiomics as a Possible Immune Evasion Mechanism in Glioma. Cancer Immunol Res. 2019 Jul;7(7):1148-1161.
- Matsushita H, Hasegawa K, Oda K, Yamamoto S, Asada K, Karasaki T, Yabuno A, Nishijima A, Nejo T, Kobayashi Y, Sato S, Ikeda Y, Miyai M, Takahashi Y, Yamaguchi R, Fujiwara K, Aburatani H, Kakimi K. Neoantigen load and HLA-class I expression identify a subgroup of tumors with a T-cell-inflamed phenotype and favorable prognosis in homologous recombination-proficient high-grade serous ovarian carcinoma. J Immunother Cancer. 2020 May;8(1):e000375.