Tumor
Immunity腫瘍免疫の基礎知識(垣見の腫瘍免疫学)
免疫学教室で実施している研究のベースとなる腫瘍免疫に関する基礎知識、考え方を概説します。
7.代謝と免疫
7.1.T細胞の分化と機能は代謝と密接に相関する
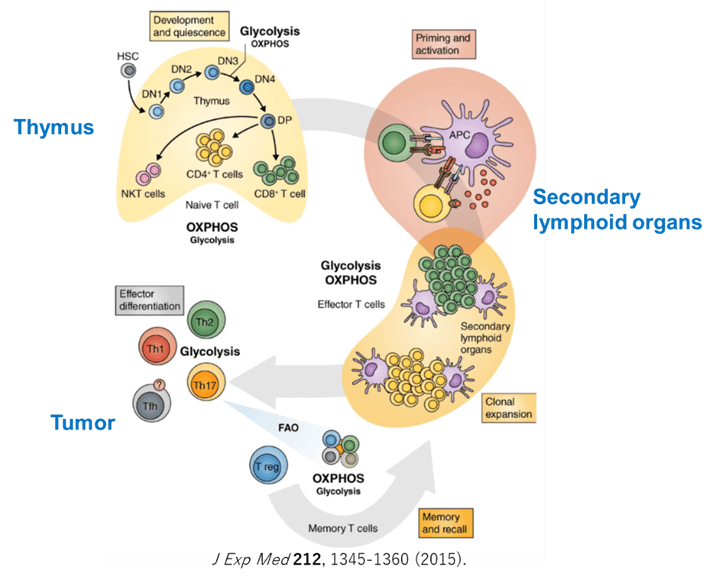
免疫応答の特徴は、一度罹患したウイルス感染などに対して、回復後長期にわたり抵抗性を獲得すること(免疫メモリー)である。ウイルスなどの病原体を排除した後、大部分のT細胞はアポトーシスに陥るが、一部のT細胞は寿命の長いメモリーT細胞に分化して長期間体内に存在し、再感染や再発時には迅速で強力な免疫応答を可能にしている。このようなダイナミックな免疫応答を示すT細胞は、ナイーブT細胞(TN)あるいは休止期のT細胞から抗原刺激によって迅速に活性化されて増殖し、エフェクターT細胞(Teff)あるいは活性化T細胞、そしてメモリーT細胞(Tm)へと分化する。Tm細胞はさらにメモリーステムセルT細胞(TSCM)、セントラルメモリーT細胞(TCM)、エフェクターメモリーT細胞(TEM)、最終分化T細胞(T TEMRA)に細分化される。Teff細胞は、機能面から、グランザイムB、パーフォリン、IFNγなどを放出する細胞傷害性T細胞(cytotoxic T lymphocyte:CTL)、産生するサイトカインによって特徴づけられるTh2、Th2、Th17のヘルパーT細胞(Th)とTregに分類される。抗腫瘍免疫応答にはTeffが重要であり、Tregがその作用を抑制する。
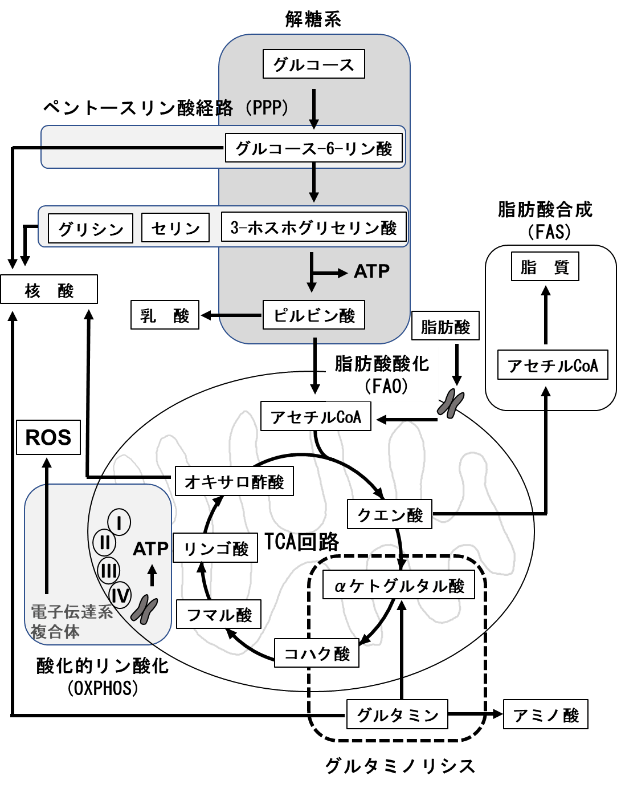
T細胞の機能は、その分化段階に応じてダイナミックに制御されており、様々なサブセットに属するT細胞には特徴的な代謝プロファイルが認められる。T細胞の代謝の理解に必要な経路を図に示す。細胞の自己複製能も細胞内の代謝により制御されており、非常に高い細胞増殖能を保持しているTNは、少量のグルコース、アミノ酸、脂肪酸を利用して、エネルギー産生効率が良い酸化的代謝を行っている。T細胞の活性化時には、代謝のリプログラミングが起こる。T細胞が抗原に遭遇し、T細胞受容体(TCR)と共刺激分子からのシグナルを受けて活性化されると、その代謝を大きく変化させTeffへと分化する。Teffは、代謝を解糖系(glycolysis)にシフトさせて、急速な細胞増殖とエフェクター機能を発揮するための活発な生合成を可能にしている。解糖系と同時にグルタミノリシスやペントースリン酸経路(pentose phosphate pathway:PPP)も活性化する。ATP産生効率の点では、好気的解糖は酸化的リン酸化(oxidative phosphorylation:OXPHOS)より劣るが、その中間代謝産物を、細胞増殖やサイトカイン産生に必要な高分子合成の材料として有効に活用できることから、細胞増殖が活発な細胞においてはメリットがあると考えられる。Th2, Th2, Th27などのTeffは好気的解糖を利用するが、Tregは脂肪酸酸化(FAO)とOXPHOSを主なエネルギー源としている。体内で長期にわたり持続するTmはミトコンドリアによるOXPHOSとFAOに依存しており、ミトコンドリアの機能や量を維持することが重要である。
7.2.T細胞の代謝制御に係る分子のネットワーク
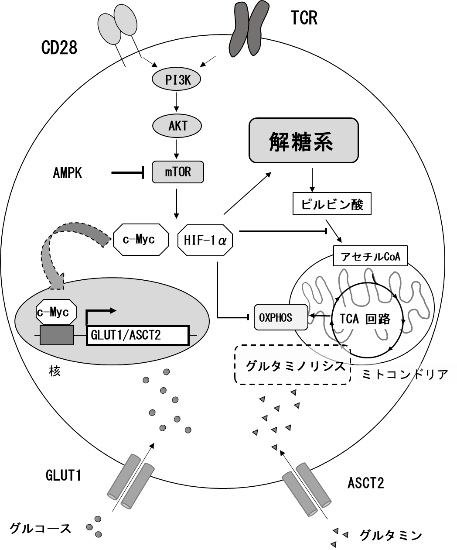
TCRと共刺激分子CD28を介したT細胞の活性化シグナルは、PI3K/AKT/mTORが深く関与している。なかでもmTORは中心的な制御分子である。mTORは、転写因子のc-MycとHIF-1αを増加させる。c-Mycは、グルコーストランスポータ―(GLUT)の発現を増強し、グルコースの流入を促進してT細胞の細胞増殖とTNからTeffへの分化を可能にする。また、グルタミントランスポーター(ASCT2)を誘導し、グルタミノリシスを促進する。HIF-1αは、解糖系の酵素の発現を上昇させるとともに、ミトコンドリアの酸素消費を低下させ、TCA回路を抑制する。mTORを抑制するAMPKも同様に重要である。他のTeffと異なり、主にFAOに依存しているTregでは、AMPKが活性化している。また、TmにおいてもエネルギーセンサーであるAMPK経路の活性化が関与している。
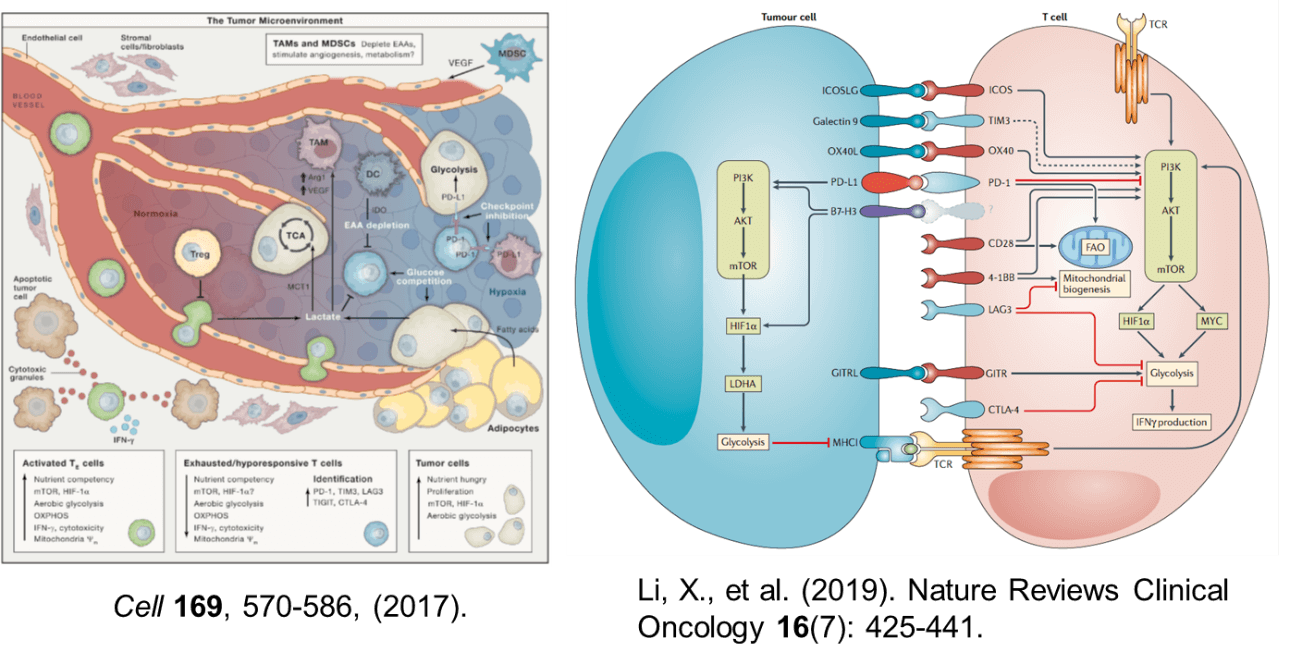
7.3.腫瘍の代謝と腫瘍内免疫抑制環境の形成
がん細胞は、自らの細胞増殖に有利になるよう代謝系をリプログラミングして、酸素の存在下でもATPの産生の効率の低い解糖系を積極的に利用し、グルコースの取り込みと乳酸産生を高めている(Warburg効果)。解糖系優位であるがん細胞の代謝の特徴は、活性化T細胞の代謝と共通点を認めるが、T細胞における代謝の遷移は、生理的な適応の一部であるが、がん細胞の代謝の変化は、がん化に係る遺伝子変異による点が異なる。p53遺伝子などのがん抑制遺伝子の欠損やPI3Kなどの腫瘍性たんぱくの活性化の結果、異常な細胞増殖能を獲得している。
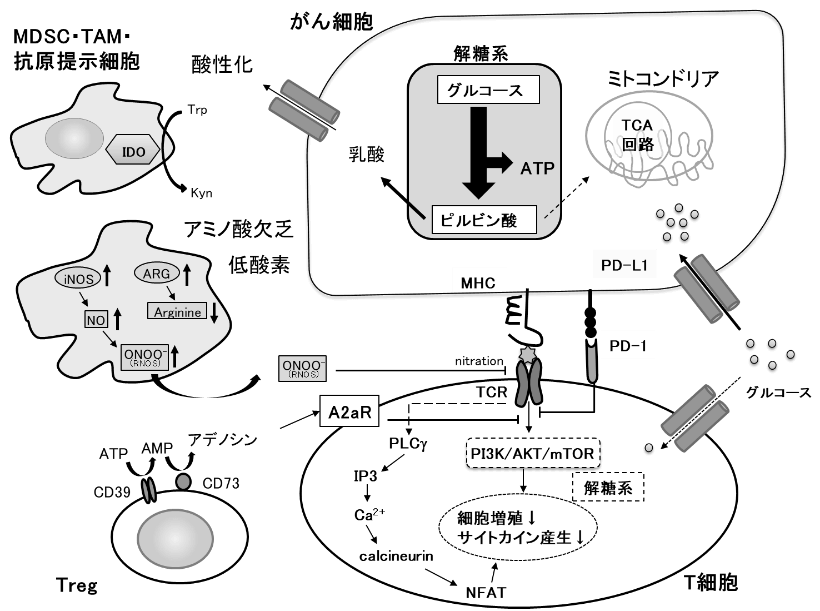
腫瘍内微小環境は、抗腫瘍T細胞の代謝活性や機能を抑制する因子であふれている。免疫抑制性の因子に加えて、腫瘍とT細胞の代謝面の競合が免疫抑制性環境の形成に関与している。T細胞はTCRに刺激を受けると、Ca2+の細胞内濃度が上昇し、カルシニューリンが活性化される。カルシニューリンの活性化により脱リン酸化された転写因子NFATが核内への移行し、他の転写因子との相互作用によりIL-2遺伝子などの転写を促進して活性化する。がん細胞が大量にグルコースを消費して枯渇させるため、グルコースをエネルギー源として必要とするTeff型の腫瘍特異的T細胞は、戦いの場である腫瘍に浸潤するとTCRにシグナルを受けても、細胞のCa2+濃度は低下し、NFATの核内への移行が減少する。このためT細胞は、機能不全に陥り、細胞増殖とサイトカイン産生が抑制される。グルコースに加えて、アミノ酸や脂肪酸などの栄養素もがん細胞に大量に消費されると、それを競合するT細胞が機能不全に陥る。このように、がん細胞の活発な増殖を支える代謝の営みが、腫瘍特異的T細胞の抗腫瘍エフェクター作用を阻害していることが明らかになってきた。
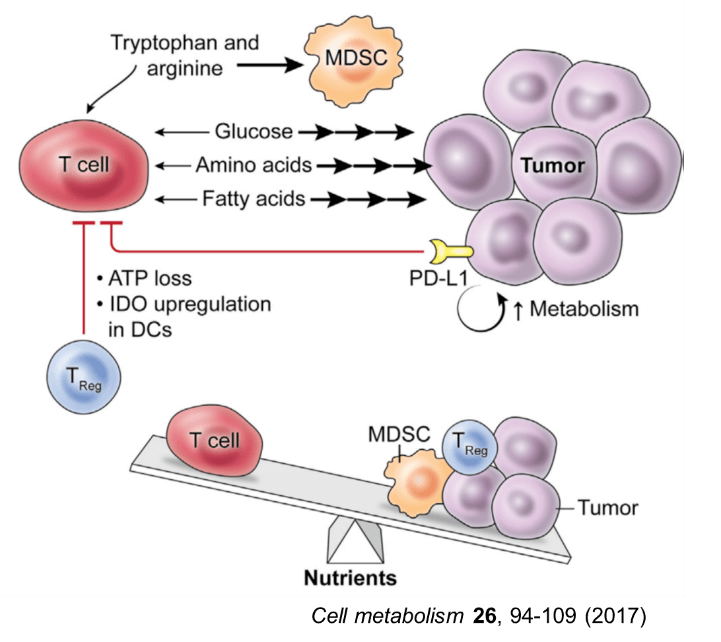
腫瘍内には、がん細胞以外にも代謝を介してT細胞の抗腫瘍活性を抑制する細胞が存在する。腫瘍内の抗原提示細胞、腫瘍関連マクロファージ(TAM)や骨髄系抑制細胞(myeloid derived suppressor cell:MDSC)では、トリプトファン代謝にかかわるindoleamine 2,3-dioxygenase(IDO)の発現誘導とアルギニン代謝にかかわるアラギナーゼの活性化が起こり、トリプトファンとアルギニンが分解され、腫瘍内はアミノ酸が枯渇する。加えて、低酸素状態ではMDSCなどにおいて誘導型一酸化窒素合成酵素(iNOS)が活性化され、反応性窒素種(Reactive Nitrogen Species: RNOS) が産生される。ペルオキシ亜硝酸(ONOO-)によりTCRがニトロ化されると、その反応性が抑制される。Tregはグルコースが枯渇している腫瘍内の環境でも生存可能であり、CD39とCD73を共発現して細胞外のATPを分解しアデノシンを産生する。細胞外のアデノシンが、T細胞上のアデノシンA2a受容体(A2aR)に結合すると、その作用を抑制する。がん細胞が解糖で産生する乳酸は、免疫抑制性のマクロファージやTregを誘導し、さらに免疫を抑制する。このように、腫瘍内では、がん細胞のみならず、多くの免疫抑制性細胞との間で代謝の基質を競合しているため、T細胞の抗腫瘍免疫応答を持続的に保つためには、代謝面の厳しい環境を克服する必要がある。
7.4.代謝制御のがん免疫治療への応用
がん免疫治療をより有効にするためには、T細胞の機能を再活性化しその作用を持続させることが必要であり、そのためには代謝の制御を併用することが重要である。解糖系の中心となるmTORの抑制は、AMPKのリン酸化を誘導し、FAO依存性のTmを増加させる。がん免疫におけるmTOR阻害剤の作用は、あるモデルではTeffを増加させ抗腫瘍効果を増強するが、別のモデルではTeffを減少させるため、抗腫瘍効果を得ることができない。用量、投与時期、腫瘍の特性など様々な要因で結果が異なる点が悩ましいが、mTORがT細胞のエフェクター活性に多大な影響を持つことは明白である。mTORに加えて、AMPKの制御を介したTmを標的とする代謝制御法とがん免疫治療の併用法も注目されている。
例えば、解糖系を標的とした治療法としては、2-デオキシ-D-グルコース(2-DG)がある。2-DGはグルコースの2-ヒドロキシル基が水素原子に置換されたグルコース誘導体で、グルコースと同様にグルコース輸送体のGLUT1を利用して細胞内に取り込まれる。解糖系酵素で代謝できないため、細胞内に蓄積し、解糖系を阻害する。直接がん細胞の代謝を抑制し増殖抑制を目指した抗がん剤としての開発が試みられている。がん細胞がオートファジーを誘導して抵抗性を示すことなどが報告されているが、直接のがん細胞に対する効果以外にも、代謝を介した免疫抑制解除効果が期待され、免疫チェックポイント阻害剤治療等との併用が期待されている。
II型糖尿病治療薬のメトホルミンは、ミトコンドリア呼吸鎖複合体Iに作用し、細胞内のATPレベルを減少させる。AMPKに作用して、解糖系に関わる遺伝子発現を減弱させ、細胞内のエネルギー状態を同化から異化へと変化させてがん細胞の増殖抑制に作用する。がん細胞のグルコース代謝を抑制することは、競合するT細胞にとっては有利に働く。しかしながら、物事はそれほど単純ではなく、T細胞に対する作用は、これまでの記述の通り、T細胞の分化段階(TeffかTmか)により、解糖が主であるのかOXPHOS/FAOが主であるのか、PI3K/AKT/mTORがON/OFFかにより異なるため、その効果は多面的に表れる。メトホルミンによるAMPKの活性化は、腫瘍浸潤リンパ球の代謝や組成に影響を与え、直接のエフェクター活性は減弱するが、増殖能をもったTmへと変化させる。
また、脂質代謝に影響を与える薬剤と免疫チェックポイント阻害剤との併用で、より一層免疫面での抗腫瘍効果を誘導することがと試みられている。
7.5.免疫チェックポイントとメタボリックチェックポイント
CTLA-4やPD-1を標的とした免疫チェックポイント阻害剤は、T細胞の解糖系の代謝活性を回復させることで、抗腫瘍免疫応答を回復させることが知られている。また、腫瘍細胞に発現するPD-L1は、腫瘍細胞のAKT/mTOR経路を活性化させ、解糖を亢進させている。そのため、PD-L1経路を阻害する抗体は、腫瘍細胞の解糖を抑制し、腫瘍内微小環境内のグルコース量を回復させる。このことにより、T細胞がグルコースを活用可能になり、IFN-γの産生が可能になる。さらに、PD-L1は、直接T細胞の機能を抑制するだけでなく、腫瘍の代謝を介してもT細胞の代謝と機能を抑制している。
このように、免疫と代謝が深くかかわっていることが明らかになり、代謝の制御の重要性が認識されるようになった。免疫チェックポイント阻害剤の成功で認知されたがん免疫治療であるが、代謝面での制御を併用することが不可欠であり、解糖、OXPHOS/FAOなどの代謝に関する分子や、その制御をつかさどるmTORやAMPKなども、メタボリックチェックポイントとして、重要ながん免疫治療の標的である。「がん免疫治療とImmunometabolism」が今後益々重要になると思われる。